2025

ISO13485医疗器械质量管理体系,是基于ISO9001国际质量管理体系要求增加了对医疗器械行业的特定要求建立的国际标准,相较ISO9001标准适用于所有类型的组织,ISO13485更具有专业...
2025

父亲节 父亲节(Father's Day),是感恩父亲的节日。约始于二十世纪初,起源于美国,现已广泛流传于世界各地,节日日期因地域而存在差异。最广泛的日期在每年6月的第三个星期日。 1...
2025

01注册基本原则基于软件安全性级别提交注册申报资料详尽程度取决于安全性级别和复杂程度独立软件和软件组件申报原则总体相同02安全性级别 YY/T 0664《医疗器械软件 软件生存周期过程》进行分级,...
2025

01如何确定有源类医疗器械货架有效期? 医疗器械货架有效期是指保证医疗器械终产品正常发挥预期功能的期限,产品设计开发阶段需完成产品货架有效期研究。可以对该产品进行使用状态列举,完整分析出临床使用的...
2025

在临床试验中,严格遵守试验方案是确保研究科学性、伦理合规性和数据可靠性的核心原则,具体原因如下:01科学性与数据可靠性1.避免偏倚试验方案通过预设的随机化、盲法、对照设计等控制系统性误差。若随意...
2025
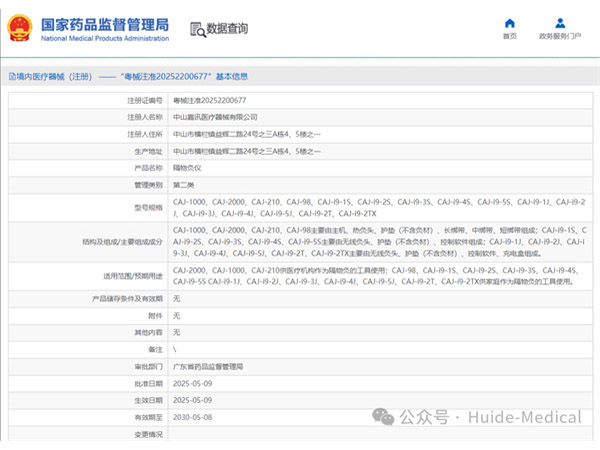
热烈祝贺,由我们汇得医疗CRO辅导合作的客户中山嘉讯医疗器械有限公司自主研发的【隔物灸仪】产品成功获批广东省药品监督管理局第二类医疗器械产品注册证,意味着该产品可以在国内医疗市场开启合法生产与销售服务...
2025

01政策背景速览 国家药品监督管理局2023年3月16日发布《关于GB 9706.1-2020及配套并列标准、专用标准实施有关工作的通告》(2023年第14号)明确要求:已获准注册的医疗器械产品,...
2025

01递交境外临床试验资料进行临床评价时,是否需要递交临床试验原始数据资料? 递交境外临床试验资料进行临床评价需符合《接受医疗器械境外临床试验数据技术指导原则》相关要求,并按照《医疗器械临床试验数据...
2025

01质量管理体系建立与改进1.查看质量管理体系文件、组织机构、人员配置、设施设备等。查看许可证/备案信息,经营方式、经营范围。2.人员履职:通过谈话、文件/记录了解质量安全关键岗位人员对职责的熟悉程度...
2025

医疗包装是指对医疗器械的初包装,可对其进行灭菌,可进行无菌操作(如洁净开启),能提供可接受的微生物阻隔性能,灭菌前后能对产品进行保护并且灭菌后能在一定期限内(标注的有效期)维持系统内部无菌环境的...
