2025
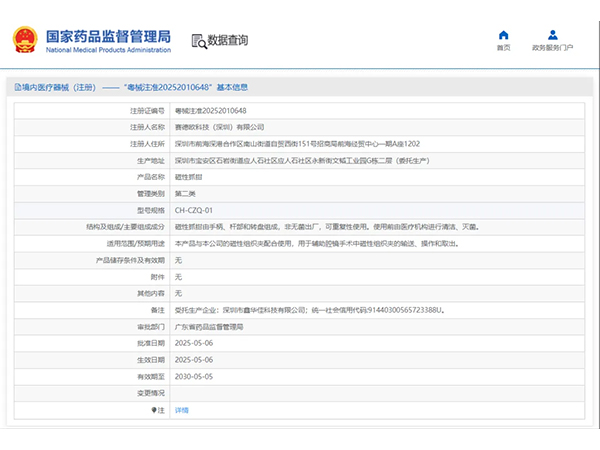
热烈祝贺,由我们汇得医疗CRO辅导合作的客户赛德欧科技(深圳)有限公司自主研发的【磁性抓钳】产品成功获批广东省药品监督管理局第二类医疗器械产品注册证,意味着该产品可以在国内医疗市场开启合法生产与销售服...
2025

在注册人制度下,非医疗器械生产企业可以建立车间进行医疗器械受托生产吗? 新修订《医疗器械监督管理条例》已经全面实施医疗器械注册人制度,可以委托具备相应条件和能力的医疗器械生产企业进行生产。受托生产...
2025
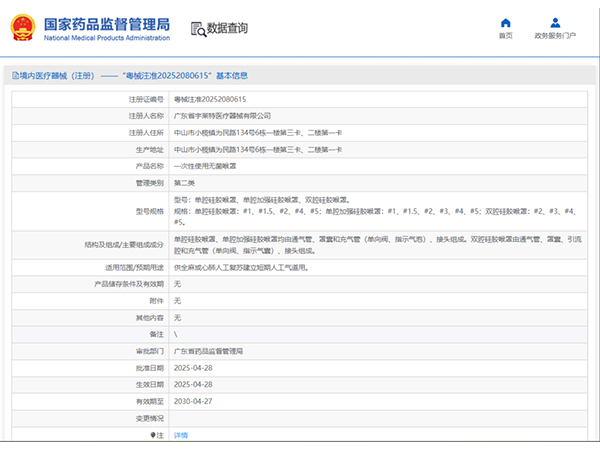
热烈祝贺,由我们汇得医疗CRO辅导合作的客户广东宇莱特医疗器械有限公司自主研发的【一次性使用无菌喉罩】产品成功获批广东省药品监督管理局第二类医疗器械产品注册证,意味着该产品可以在国内医疗市场开启合法...
2025

国际护士节 国际护士节(International Nurses Day),时间为5月12日,是为纪念现代护理学科的创始人弗洛伦斯·南丁格尔作出的贡献而设立的节日。 1912年,国际护士理事会...
2025

01政策法规1. 国家药监局医疗器械技术审评中心(以下简称器审中心)发布《医疗器械技术审评中心创新医疗器械特别审查申请审查实施细则》《医疗器械技术审评中心医疗器械优先审批申请审核实施细则》,以进一步优...
2025

01医疗器械库“三色五区五距”管理三色指:是指:红、绿、黄。红色是不合格品区;黄色指退货区、待验区;绿色是指合格品区、发货区。五区指:待验区、合格品区、不合格品区、退货区、发货区。五距指:货位之间的距...
2025

我公司想申报注册一款II类低强度的超声治疗仪,但是关于这个产品我们想知道作为生产企业必须应具备哪些硬件条件?比如至少应能自检/开展哪些试验?我查到,出厂检应至少包含输出功率的准确性检验,还有其他的吗?...
2025

医疗设备“超期服役”情况时有发生,究其原因,无外乎以下几种:1、监管机关监管缺失;2、医院领导漠视;3、注重眼前利益。 医疗设备生产厂家在其产品出厂时,会在产品铭牌上标注设备名称、规格型号、生产...
2025

工业和信息化部等七部门关于印发《医药工业数智化转型实施方案(2025—2030年)》的通知(来源:国家药品监督管理局)01医药工业数智化转型实施方案(2025—2030年) 医药工业高质量发展是推...
2025

医疗器械经营企业在采购医疗器械时,需要遵守一系列严格的要求以确保产品的质量和安全性。以下是一些关键的采购要求:01供应商资质审核 在首次采购医疗器械前,应当获取并审核供货者的相关资质文件,确保其...
