2025

祝贺陶老师《无菌医疗器械飞行检查相关问题及分析解决方法》培训圆满成功!学员热情参与,互动活跃。陶老师针对近两年无菌医疗器械飞行检查中的不符合项逐条分析讲解,并对《规范》每一章节的主要关注点进行了全...
2025

以下文章来源于医企学习网,作者小保一、集采政策:持续深化与多维影响近年来,医疗器械耗材价格治理不断深入,带量采购已成为压实耗材价格水分的关键举措,且基本实现了大品类的全覆盖。国家医保局的计划显示,今年...
2025

医疗器械是指直接或者间接用于人体的仪器、设备、器具、体外诊断试剂及校准物、材料以及其他类似或者相关的物品。其中无源医疗器械和有源医疗器械在多个方面存在不同:01能源依赖方面无源医疗器械:不依靠任何电能...
2025

讲师介绍汇得医疗技术服务集团联合创始人·集团副总经理·技术售后服务 总顾问 *17年医疗器械法规、注册、标准、认证、产业政策咨询 高级顾问 中山市医疗器械行业协会秘书长 *中山科学技术进步奖...
2025
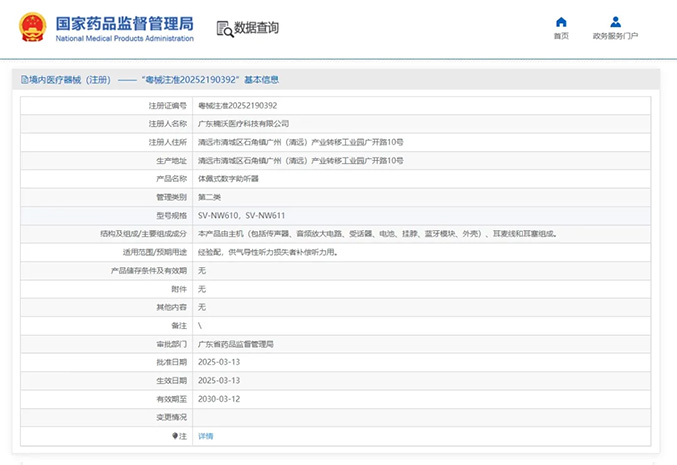
热烈祝贺,由我们汇得医疗CRO辅导合作的客户广东楠沃医疗科技有限公司自主研发的【体佩式数字助听器】产品成功获批广东省药品监督管理局第二类医疗器械产品注册证,意味着该产品可以在国内医疗市场开启合法生产...
2025

需要进行临床试验的体外诊断试剂产品,申请增加样本类型的变更注册时,是否可以选择本公司已上市的产品作为对照试剂进行临床试验? 在样本类型可比的前提下(经样本适用性研究,不同样本类型性能指标相同、阳性...
2025
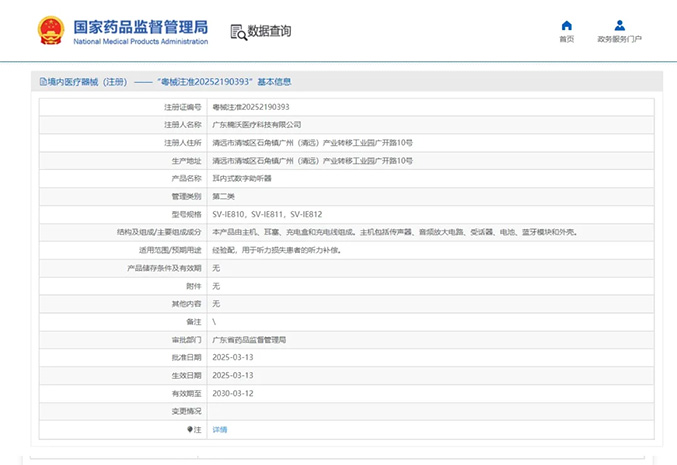
热烈祝贺,由我们汇得医疗CRO辅导合作的客户广东楠沃医疗科技有限公司自主研发的【耳内式数字助听器】产品成功获批广东省药品监督管理局第二类医疗器械产品注册证,意味着该产品可以在国内医疗市场开启合法生产与...
2025

01血管夹的定义 在进行显微外科操作时用于术中夹闭血管以阻断血流,并固定血管,从而辅助术者缝合血管的无创性精细手术器械。可分为动脉夹、静脉夹。02血管夹的分类 根据《医疗器械分类目录》,分类编...
2025

01准备备案资料 需准备第一类医疗器械备案表、关联文件、产品技术要求、产品检验报告、产品说明书及最小销售单元标签设计样稿、生产制造信息、符合性声明等。其中,关联文件境内备案人需提供企业营业执照副本...
2025
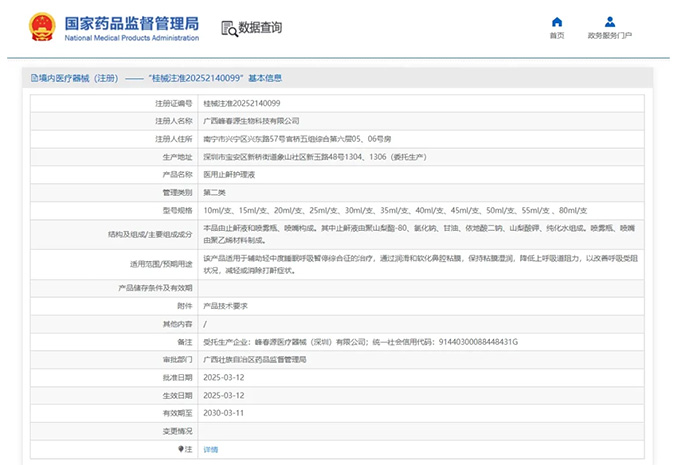
热烈祝贺,由我们汇得医疗CRO辅导合作的客户广西峰春源生物科技有限公司自主研发的【医用止鼾护理液】产品成功获批广西壮族自治区药品监督管理局第二类医疗器械产品注册证,意味着该产品可以在国内医疗市场开启...
