2025

惊蛰 惊蛰 [ jīng zhé ],是二十四节气中的第三个节气,标志着仲春时节的开始。每年3月5日或6日,视太阳到达黄经345度时为惊蛰。 “惊蛰”,是“立春”以后天气转暖,春雷始鸣,惊醒蛰...
2025

01背景介绍 校准品(Calibrator),主要用于校准检测仪器和检测方法,以保证检测结果的准确性和一致性,其作为校准函数中用作独立变量值的参考物质,是体外诊断试剂或检测系统中的重要组成部分,也...
2025

01基础资质与申请表1.创新医疗器械特别审查申请表需完整填写产品名称、性能结构、工作原理、预期用途等关键信息,确保表述专业无歧义。需注明专利授权时间,确保申请时间距专利授权公告日不超过5年。2....
2025
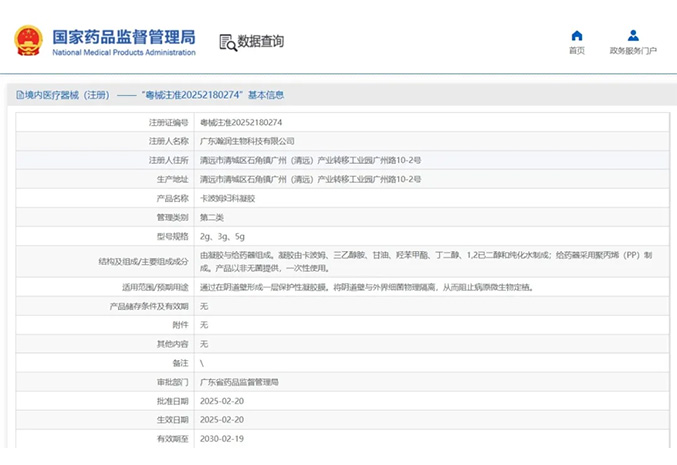
热烈祝贺,由我们汇得医疗CRO辅导合作的客户广东瀚润生物科技有限公司自主研发的【卡波姆妇科凝胶】产品成功获批广东省药品监督管理局第二类医疗器械产品注册证,意味着该产品可以在国内医美医疗市场开启合法生产...
2025
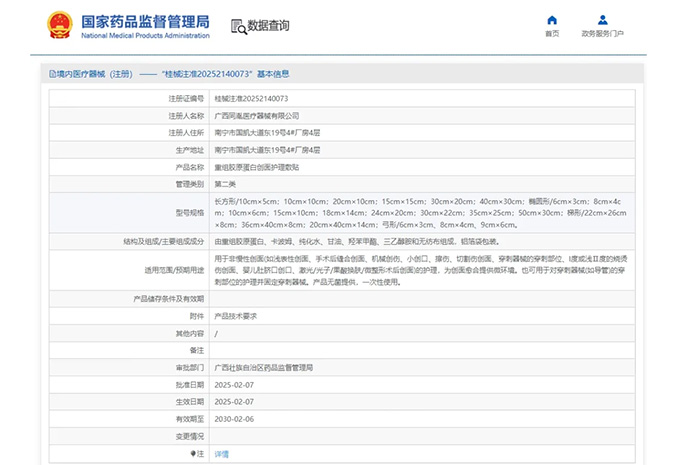
热烈祝贺,由我们汇得医疗CRO辅导合作的客户广西同胤医疗器械有限公司自主研发的【重组胶原蛋白创面护理敷贴】产品成功获批广西壮族自治区药品监督管理局第二类医疗器械产品注册证,意味着该产品可以在国内...
2025

基于医疗器械本身的风险,同时结合评价该医疗器械安全性和有效性所需的监管措施和力度,美国FDA对医疗器械进行分类管理,一共三个管理类别,分别为I类、II类和III类。随着对部分医疗器械的安全性有效...
2025

01家用医疗器械核心分类与适用场景1.检测监测类代表产品:自动体外除颤器(AED)、防褥疮气垫床、颈椎牵引器、助行器等。适用场景:心脏骤停急救、长期卧床护理、运动损伤恢复等。2.治疗干预类代表产...
2025

医疗器械的管理类别受多个因素影响,主要包括以下几个方面:01风险程度 医疗器械的风险程度是分类界定的核心考量。这包括对使用过程中可能产生的风险的评估,如对患者和操作者的安全风险。风险越高的医疗器...
2025

无菌医疗器械的生产环境要求非常严格,以确保产品的安全性和有效性。以下是对无菌医疗器械生产环境要求的详解,涵盖洁净室(区)分级标准、环境控制参数、环境监测与管理、人员与物料管理、设备与工艺控制等方面:...
2025

01生产过程控制及工艺1.缺乏投料记录或生产加工过程中关键控制点的记录。2.原材料台账记录与投配料记录不对应。3.生产记录中分装原料缺少生产批次信息。4.未能提供产品的生产批次及数量。5.产品生产工艺...
